|
CAFC判決 Endo
Pharmaceuticals v. Teva Pharmacenticals 2019年
03月 28日 101条の保護適格性が認められた判決。
OPINION by JUDGE STOLL Summarized by Tatsuo YABE –
2019-04-14 |
|
Vanda判決(2018年)以降に保護適格性(101条のEligibility)が認められた治療方法に関する事案である。Vanda判決においてはMayo判決(2012年最高裁)でのクレームとの相違が良く理解できなかったが今回の判決で治療方法に関するクレームの保護適格性(Eligibility)をCAFCがどのように判断するかが明瞭になったと理解します。
|
即ち、薬の投与量と人体の反応(薬物動態)との関係を規定するクレームにはEligibilityを認めない、しかしながら当該関係を利用し薬の投与量(あるいはその頻度)を規定するステップがクレームにある場合にはEligibility
を認める。(以上筆者)
■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■
|
■ 特許権者:Endo
Pharmaceuticals
■ 被疑侵害者:Teva
Pharmaceuticals; Actavis Pharma
■ 特許:USP
8,808,737
■ 特許発明の概要:
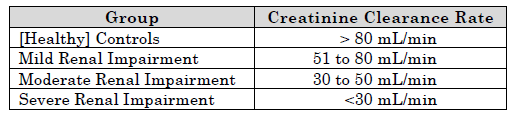
Endo737特許は腎機能障害のある患者の痛みを治療(緩和)する手法に関する。痛みの緩和のためオキシモルホン(oxymorphone)を投与するにあたり腎機能障害のレベル(クレアチニン”creathinine”をろ過する速度で測定する)に応じてオキシモルホンの投与量を調整する手法をクレームしている。
|
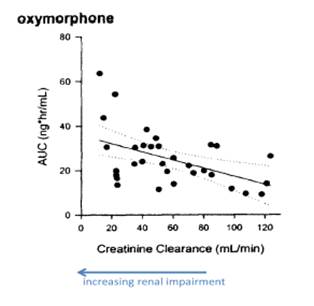
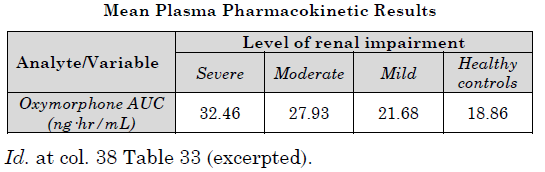
腎機能障害に起因する痛みを緩和するためにオキシモルホンを投与するにあたり、痛みの緩和レベルは患者の身体のオキシモルホンに対する反応によって異なる。737特許の発明者は腎機能疾患のオキシモルホンの薬物動態に対する影響を研究した。腎機能疾患の度合いが中程度から重度の患者に対してはオキシモルホンの投与量を少なくすることで同程度の鎮痛を可能にすることを発見した。言い換えると当該発明者は腎機能障害のある患者に対してより安全に且つ効果的に痛みを緩和する方法を発明したと言える。より詳細にはオキシモルホンのAUC(薬が初所定時間経過後に血液内に残存しているかを示す値)と患者の腎機能障害のレベル(クレアチニン濾過速度で代表される)との間に顕著な相関関係があることを統計的に発見した。
|
|
以下の図で示すように患者の疾患レベルが中程度〜重度(クレアチニン濾過速度が50mL/min以下)になるまではオキシモルホンのAUC値におおきな変化は見られない。但し、腎機能障害レベルが重度の患者のAUC値が最も高いことは理解できる。
|
|
上記統計データより、腎機能に障害がある人の方が腎機能が正常な人よりもオキシモルホンが血液中に残存ずる度合いが多いことが理解できる。例えば、重度の障害を持つ人のAUC値は腎機能が正常な人のAUC値の1.7倍である。
|
上記の発見と統計値を基に737特許クレームの発明に至った。
■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■■
|
■ 争点:
737特許クレーム1はAlice/Mayo判決に基づき101条の特許保護適格性を満たすか?
|
■ 代表的な737特許のクレーム:
|
|
8,808,737特許クレーム1 |
概要和訳 |
|
1. A method of treating pain in a renally impaired patient,
comprising the steps of: a. providing a solid oral controlled release dosage
form, comprising: i.
about 5 mg to about 80 mg of oxymorphone or a pharmaceutically
acceptable salt thereof as the sole active ingredient; and ii.
a controlled release matrix; b. measuring a creatinine clearance rate of the
patient and determining it to be (a)
less than about 30 ml/min, (b)
about 30 mL/min to about 50 mL/min, (c)
about 51 mL/min to about 80 mL/min, or (d)
above about 80 mL/min; and c. orally administering to said patient, in
dependence on which creatinine clearance rate is found, a lower dosage
of the dosage form to provide pain relief; wherein
after said administration to said patient, the average AUC of
oxymorphone over a 12-hour period is less than about 21 ng·hr/mL. |
腎臓に機能障害のある患者の苦痛を治療するための手法であって、 [a] 以下(i):(ii)を含む口内投与可能な固形状の薬の投与量のフォームを準備する; (i) 5mg〜80mgのオキシモルホン或いは薬事法で許容されたオキシモルホンの塩を唯一の成分とする薬;及び、 (ii) 管理された投与Matrix [b] 患者のクレアチニン濾過速度を測定し、以下のどのカテゴリーに入るかを決定する;
a: 約30mL/min以下; b: 約30mL/min
– 約50mL/min;
c: 約51mL/min
– 約80mL/min;
d: 約80mL/min以上 [c] 上記で決定されたクレアチニンろか速度に応じて、前記フォームの少ない投与量を患者に口内投与する; 投与後、12時間経過しオキシモルホンの平均AUC値が21ng.hr/mLとなるようにすること。 |
|
■ 地裁判決:
Mayo/Alice最高裁判決の判示(Aliceパート1とパート2テスト)を適用し737特許クレーム1は101条の要件を満たさないと判断した。
737特許クレーム1は自然法則に対する(directed
to)。737特許のproviding
stepはMayo判決におけるadministering
stepに対応し、measuring/determining stepsはクレアチニンのレベルを測定し必要な情報を得るという周知のステップによって自然法則を適用しているにすぎないとし、737特許クレーム1は保護適格性はないと判示した。
|
■ CAFC判決:
地裁判決を破棄する:
|
Alice最高裁判決で判示された2ステップテストを適用し737特許クレーム1の101条保護適格性(Eligibility)を判断する。2016年のEnfish判決(CAFC判決)で判示したように、ステップ1でクレームが保護適格性のない主題にdirected
to(照準を合わせている)していない(not
directed to a patent-ineligible concept at step one)と判断される場合にはステップ2を検討する必要はない。
|
ステップ1を判断するにあたり、クレームの構成要素に保護適格性のない概念が存在するか否かを判断するだけでは不十分であり、保護適格性のない概念を対象(“directed
to”)とするようにクレームしているか否かを判断しなければならない(we
must determine whether the patent-ineligible concept is what the claim is
“directed to”)。
|
上記に基づき判断するに737特許クレーム1は特許保護適格性のない主題を対象とするものではない。寧ろ、当該クレームは腎機能障害のある患者にオキシモルホンを投与し治療する手法を対象とするもので保護適格性を有する。当該クレームは(a);
(b); (c)で規定された特定のステップを規定しており、明細書、Abstract、発明の要旨(Summary)と整合性がある。
|
2018年のVanda判決においてCAFCは同様のクレームに保護適格性を認めた。Vanda判決で問題となった特許USP8586610のクレーム1で、統合失調症の患者をイロぺりドン(投薬)で治療する手法を規定している。イロペリドンという薬は心臓の自然のリズムを乱す(QTc
Prolongationと言う)原因になる場合があり、CYP2D6による代謝機能が低い患者には一日当たりの投与量を12mg以下に抑えることを規定している。
注意:CYP2D6による代謝機能が欠損している人とは、肝臓において薬物代謝を担う酵素であるCYP2D6の薬物代謝機能が欠乏している人を意味する。
|
737特許クレーム1はVanda判決で101条適格性が認められたクレームと法的には識別されるものではない(同じである)。即ち、737特許クレーム1とVanda判決のクレームは共に患者を治療する手法を規定している。Vandaのクレームにおいても遺伝子テストの結果に基づき特定の薬の投与量を規定している。本事案(737特許クレーム1)でも同様に腎機能テストの結果に基づき投与量を決定するステップを規定している。さらにVanda及び本事案において共に特定の疾患に対する治療手法を規定している。
|
Vanda判決と同様に、本事案においてもMayo判決で問題となったクレームとの違いは明白である。Mayo事件のクレームにおいてはadministeringステップ(投与ステップ)は最初のステップとして規定されており、特定の疾患のある患者に特定の薬を投与すると規定しているのみであって、クレーム全体として薬を特定の病(疾患)を治療することを対象とするものではない。737特許クレーム1では腎機能テストの結果を基に特定の薬の投与量を規定している。Vanda判決において、発明者は患者の代謝遺伝子のタイプとイロペリドンの投与量との関係を発見するも、その関係をクレームしているのではない。同様に本事案においても発明者は腎機能障害とオキシモルホンとの関係を発見するも、それをクレームしているのではない。あくまで発見した当該関係を特定の疾患を治療するために適用する手法をクレームしている。
|
Mayoにおいては、チオグアニンを投与し血中における代謝のレベルを測定し、投与量を増やすか或いは減らすことを示していると規定しているのみで、Vanda或いは本事案のように示された結果に基づき投与量を特定するステップに対する規定がない。
|
さらに、Actavis(被疑侵害者)は本事案のクレームはVanda判決とは異なり患者のクレアチニンをろ過する速度に応じたオキシモルホンの特定の投与量或いは投与の頻度に関して言及していないと主張した。Actavisの主張は容認できない。737特許クレーム1のWhereinクローズにおいて投与後12時間でオキシモルホンの目標AUC値が21
ng.hr/mLとなるようにオキシモルホンの投与量と頻度を管理することを要求している。このように本事案において、クレームのステップを経た後に医者がなしうる治療方法の全てに権利範囲を及ぼすものではない。
|
依って、737特許クレーム1はEligibleであり、地裁判決を破棄する。